quarta-feira, 11 de dezembro de 2013
Ligações Covalentes (continuação)
Ligações covalentes múltiplas em moléculas diatómicas
Por vezes os núcleos dos átomos que intervêm na ligação química compartilham mais do que um par eletrónico, Assim sendo, estabelecem-se ligações covalentes múltiplas, que podem ser duplas ou triplas.
Ligação covalente dupla - A molécula de oxigénio (O2)
A molécula de oxigénio é constituída por dois átomos de oxigénio.
8O - 8 eletrões: 2 - 6 -> 6 eletrões de valência
Ligações Químicas - Ligação Covalente
Ligação covalente simples em moléculas diatómicas
A matéria é constituída por átomos de diferentes elementos químicos que se combinam entre si das mais variadas formas.
Quando os átomos se combinam, ocorrem interações entre eles, formando-se "elos", ou seja, ligações químicas. São estas ligações que explicam a imensa variedade de substâncias que existem no Universo.
Molécula de hidrogénio (H2)
Quando dois átomos de hidrogénio se aproximam, surgem novas interações elétricas entre eles:
- forças repulsivas entre os eletrões de cada um dos átomos e entre os núcleos dos dois átomos;
- forças atrativas entre o eletrão de cada um dos átomos e o núcleo do outro.
 |
| interações que ocorrem quando dois átomos de hidrogénio se aproximam |
As interações resultantes dependem da distânciaa a que os átomos se encontram. Ao diminuir a distância entre os dois átomos, há um aumento das forças atrativas. Contudo, existe uma distância a partir da qual as forças repulsivas se sobrepõem às forças atrativas.
 |
| energia das interações entre dois átomos de hidrogénio em função da distância |
A ligação química ocorre quando, a uma determinada distância entre os núcleos de dois átomos, as forças atrativas são mais intensas do que as forças repulsivas e a energia potencial é mínima.
A nuvem eletrónica da molécula de hidrogénio é mais densa nas zonas próximas dos núcleos dos átomos e na região internuclear (entre os núcleos), onde é mais provável encontrar os eletrões, sendo menos densa nas zonas mais afastadas dos núcleos, onde é menos provável encontrar os eletrões. As moléculas são constituídas por dois ou mais núcleos (dependendo do número de átomos que formam a molécula) e uma única nuvem eletrónica.
Quando os dois átomos estabelecem uma ligação, cada eletrão, que inicialmente pertencia ao seu átomo de hidrogénio passa a pertencer aos dois átomos, pois passa a movimentar-se mais tempo na região internuclear.
Os eletrões ao passarem a pertencer aos dois átomos são os responsáveis pela ligação química designada por ligação covalente.
Deste modo, os dois átomos ligados ficam com o número máximo de eletrões de valência permitindo no nível n = 1 (dois eletrões), a que corresponde maior estabilidade. Como tal, uma molécula de hidrogénio é mais estável do queo conjunto constituído por dois átomos de hidrogénio separados.
No caso da molécula de hidrogénio, como a ligação consiste na compartilha de um único par eletrónico, ou seja, na partilha de dois eletrões por dois núcleos de dois átomos, a ligação designa-se por ligação covalente simples.
A notação de Lewis é um modo de representar esquematicamente os eletrões de valência e as ligações químicas covalentes. Consiste na representação de cada átomo pelo seu símbolo químico rodeado de pontos ou cruzes, que simbolizam os eletrões de valência (os pontos e as cruzes são utilizados para distinguir os eletrões que originalmente pertenciam a átomos diferentes).
No caso das moléculas, os eletrões partilhados são colocados entre os dois símbolos químicos.
 |
| representação de Lewis da molécula de hidrogénio |
 |
| fórmula de estrutura da molécula |
A fórmula de estrutura permite a representação das moléculas, evidenciando as ligações químicas covalentes por meio de traços simples entre os símbolos químicos.
 |
| molécula de hidrogénio |
Na figura acima, a nuvem eletrónica encontra-se igualemente distribuída entre os dois átomos, pois os átomos são iguais.
Assim, não existe uma região mais eletronegativa do que outra, logo a ligação covalente é apolar (não tem pólos elétricos) e a molécula também é apolar.
A distância média entre os núcleos dos dois átomos ligados designa-se comprimento da ligação, que no caso da molécula de hidrogénio é de 74 pm.
Elemento Químico - Oxigénio
Oxigénio
Símbolo: O
Número atómico: 8 ( 8 protões e 8 eletrões )
Massa atómica: 16
Período ( linhas ): 2
Grupo ( colunas ): 16
Na sua forma molecular, O2, é um gás a temperatura ambiente, incolor (azul em estado líquido e sólido), insípido, inodoro, comburente, não combustível e pouco solúvel em água.
Representa aproximadamente 20% da composição da atmosfera terrestre. É um dos elementos mais importantes da química orgânica, sendo, esta molécula, formada durante a fotossíntese das plantas e, posteriormente, utilizada pelos seres vivos no processo de respiração.
Uma outra molécula também formada por átomos de oxigénio é o ozônio (O3), cuja presença na atmosfera protege a Terra da incidência de radiação ultravioleta do Sol.
 |
| aparência do oxigénio |
segunda-feira, 9 de dezembro de 2013
Variação do tamanho dos átomos ao longo da Tabela Periódica
O tamanho de um átomo é difícil de medir, uma vez que os eletrões não estão localizados a uma distância definida em volta do núcleo, pois encontram-se em constante movimento.
O método de determinação do raio atómico consiste em considerar os átomos como se eles possuíssem forma esférica e estivessem em contacto uns com os outros (como se as suas nuvens eletrónicas se tocassem). Assim, o raio atómico (r) será igual a metade da distância entre os núcleos (d) de dois átomos "vizinhos" do mesmo elemento (raio covalente).
Ao longo do grupo, o raio atómico aumenta de cima para baixo, pois aumenta o número de níveis de energia ou camadas eletrónicas.
Ao longo do período, raio atómico diminui, pois, apesar de o número atómico (Z) aumentar, o número de camadas permanece constante, aumentando a atração núcleo-nuvem eletrónica ocorrendo, assim, uma contração da nuvem eletrónica.
 |
Tabela Periódica (continuação)
Grupo 17 - Halogéneos
Os halogéneos encontram-se no lado direito da Tabela Periódica, pelo que não apresentam propriedades metálicas.
Todos os elementos deste grupo têm sete eletrões de valência, dando origem a iões mononegativos, por captação de um eletrão, adquirindo assim a estrutura do gás nobre mais próximo.
Propriedades físicas dos halogéneos:
- o flúor e o cloro são gasosos, o bromo é líquido e o iodo e o astato são sólidos;
- ó flúor é amarelo-esverdeado, o cloro é verde, o bromo é vermelho e o iodo é cinzento;
- são pouco solúveis em água e solúveis em solventes orgânicos;
- apresentam pontos de fusão e de ebulição baixos, quando comparados com os metais.
Propriedades químicas dos halogéneos
Os halogéneos são muito reativos e apresentam semelhanças no comportamento químico.
Como são muito reativos, não existem livres na Natureza.
Formam compostos com os metais alcalinos e metais alcalino-terrosos originando os sais respetivos, que são compostos iónicos. Estes sais designam-se por halogenetos.
Os halogéneos reagem igualmente com o hidrogénio.
H2 (g) + F2 (g) --> 2 HF (g) H2 (g) + Cl2 (g) --> 2 HCl (g)
H2 (g) + Br2 (g) --> 2 HBr (g) H2 (g) + l2 (g) --> 2 Hl (g)
Estes compostos são particularmente importantes, pois as suas soluções apresentam características ácidas.
Os halogéneos são utilizados para diferentes fins.
Exemplos: o cloro é utilizado para a desinfetação das águas das piscinas;
o flúor em doses moderadas contribui para a redução das cáries dentárias e solidez dos ossos.
Grupo 18 - Gases Nobres
Os elementos deste grupo apresentam oito eletrões de valência, à exceção do hélio que possui dois eletrões de valência. Por este motivo, apresentam uma configuração eletrónica muito estável, existindo, portanto, como espécies monoatómicas.
O grupo dos gases nobres já foi também designado por grupo dos "gasos raros" ou "inertes". A designação de "gases raros" devia-se ao facto de se pensar existirem em pequena quantidade à superfície da Terra. A designação de "gases inertes" teve como fundamento o facto de até à década de sessenta não ser possível provocar qualquer reação com estes elementos. No entanto, hoje são já conhecidas algumas reações químicas, nomeadamente com o flúor.
Os gases nobres apresentam forças de atração entre os seus átomos muito fracas e por isso têm pontos de fusão e de ebulição baixos.
Exemplos: o hélio tem uma densidade inferior ao ar, pelo que é muito utilizado para encher balões;
o néon e o xénon são utilizados nos faróis dos automóveis.
 |
| Tabela Periódica |
sexta-feira, 6 de dezembro de 2013
Tabela Periódica
A Tabela Periódica está dividida em duas grandes categorias: os metais e os não-metais. Os metais encontram-se do lado esquerdo da Tabela Periódica e os não-metais do lado direito. Os metais dos grupos 3 a 11 são metais ou elementos de transição. Os elementos dos grupos 1, 2 e 13 a 18 continuem os elementos representativos.
 |
Grupo 1 - Metais Alcalinos
Designam-se metais alcalinos por reagirem violentamente com a água, dando origem a soluções básicas ou alcalinas.
Os elementos deste grupo possuem um eletrão de valência, eletrão esse que tem tendência a sair, transformando-se num ião monopositivo, de modo a adquirir a estrutura eletrónica do gás nobre mais próximo.
O hidrogénio ( H ), embora apareça no grupo 1, não é um metal alcalino.
Propriedades físicas dos metais alcalinos:
- serem dúcteis e maleáveis;
- apresentam brilho metálico nas superfícies de corte recente;
- terem pontos de fusão e de ebulição relativamente elevados;
- serem bons condutores do calor e da eletricidade.
Propriedades químicas dos metais alcalinos
Reagem com o oxigénio atmosférico, originando óxidos metálicos, isto é oxidam-se. Por este motivo têm que ser guardados em petróleo ou parafina líquida.
Exemplo: 4 Li (s) + O2 (g) --> 2 Li2O (s) (óxido de lítio)
Os óxidos, peróxidos e superóxidos metálicos obtidos, quando dissolvidos em água, originam hidróxidos. Estas soluções apresentam carácter básico ou alcalino, o que pode ser verificado experimentalmente
utilizando solução alcoólica de fenolftaleína, que apresentará cor rosa carmim.
Exemplo: Li2O (s) + H2O (l) --> 2 LiHO (aq) (hidróxido de lítio)
Os metais alcalinos reagem com a água, originando os hidróxidos do respetivo metal e libertando hidrogénio, no estado gasoso.
Exemplo: 2 Li (s) + 2 H2O (l) --> 2 LiHO (aq) + H2 (g)
Ao observarmos as reações dos metais alcalinos com a água, podemos verificar que a reatividade aumenta do lítio para o potássio. À medida que descemos no grupo, o eletrão de valência encontra-se mais afastado do núcleo sendo, por isso, menos atraído por este. Deste modo é necessário menor energia para retirar o eletrão de valência, à medida que descemos no grupo e, como tal, a reatividade é maior.
Grupo 2 - Metais alcalino-terrosos
Designam-se por metais alcalino-terrosos pelo facto de se chamarem "terras" aos óxidos destes metais.
Os elementos deste grupo possuem dois eletrões de valência, que têm tendência a ceder, transformando-se em iões dipositivos, adquirindo a estrutura eletrónica do gás nobre mais próximo.
Propriedades físicas dos metais alcalino-terrosos:
- serem dúcteis e maleáveis;
- apresentam brilho metálico;
- terem pontos de fusão e de ebulição relativamente elevados;
- serem bons condutores de calor e de eletricidade.
Propriedades químicas dos metais alcalino-terrosos
Os metais alcalino-terrosos sofrem com facilidade reações de oxidação.
As reações de oxidação do magnésio e do cálcio são representadas pelas seguintes equações químicas:
2 Mg (s) + O2 (g) --> 2 MgO (s)
2 Ca (s) + O2 (g) --> 2 CaO (s)
Os óxidos metálicos obtidos, quando dissolvidos em água, originam hidróxidos. Estas soluções apresentam carácter básico ou alcalino, o que pode ser verificado experimentalmente utilizando uma solução alcoólica de fenolftaleína, que apresentará cor rosa carmim.
Os metais alcalino-terrosos reagem com a água libertando hidrogénio gasoso, embora a reação seja muito mais lenta do que a dos metais alcalinos.
Estas reações são traduzidas pelas seguintes equações químicas:
Mg (s) + 2 H2O (l) --> Mg(HO)2 (aq) + H2 (g)
Ca (s) + 2 H2O (l) --> Ca(HO)2 (aq) + H2 (g)
Ao realizar experimentalmente estas reações, podemos observar que o cálcio reage com maior intensidade do que o magnésio, porque os eletrões de valência são menos atraídos pelo núcleo, sendo mais fácil retirá-los.
Períodos e Grupos da Tabela Periódica
A Tabela Periódica encontra-se organizada em grupos e períodos. É constituída por sete períodos, linhas, e dezoito grupos, colunas. Atualmente é composta por 111 elementos químicos diferentes, dos quais cerca de noventa ocorrem naturalmente, sendo os restantes sintetizados pelo Homem.
Períodos
A Tabela Periódica é, como foi referido anteriormente, constituída por sete períodos, que correspondem às suas sete linhas.
O período em que se encontra o elemento corresponde ao número de níveis de energia ou camadas eletrónicas preenchidas.
Assim, os elementos do primeiro período têm um nível energético preenchido ( camada K ), os elementos do segundo período possuem dois níveis de energia preenchidos ( camadas K e L ), e assim sucessivamente.
Grupos
A Tabela Periódica é constituída por dezoito grupos, que correspondem às suas dezoito colunas.
O sistema de numeração dos grupos da Tabela Periódica atualmente utilizado, é recomendado pela União Internacional de Química Pura e Aplicada ( IUPAC ). A numeração é feita em algarismos árabes de um a dezoito, da esquerda para a direita.
Os grupos são constituídos por conjuntos de elementos químicos, com comportamento químico semelhante, apresentando o mesmo número de eletrões de valência.
Tabela Periódica - História
1789
Antoine Lavoisier, um nobre francês, publicou um livro no qual os elementos químicos conhecidos eram classificados e agrupados de acordo com as suas propriedades.
1817
O químico alemão Johann Dobereiner observou que havia grupos de três elementos que apresentavam propriedades muito semelhenates - Lei das Triades.
1862
Alexandre de Chancourtois propôs um modelo em que os elementos se distribuíam ao longo de uma linha helicoidal ( caracol de Chancourtois ).
1863
John Newlands, químico britânico, organizou todos os elementos conhecidos por ordem crescente da massa dos seus átomos. Esta distribuição ficou conhecida por "Lei das Oitavas", fazendo uma analogia entre as notas musicais e os elementos da Tabela Periódica. Embora na altura a generalização de Newlands não fosse aceite, ela foi o começo da Tabela Periódica dos Elementos actual.
1869
Dimitri Mendeleev, químico russo, publicou outra Tabela Periódica onde organizou os elementos de acordo com a massa dos seus átomos e colocou os elementos com propriedades semelhantes uns debaixo de outros numa coluna vertical.
Quando um elemento não parecia ajustar-se, deixou um espaço em branco.
Afirmou que outro elemento seria descoberto, com propriedades que se ajustariam a esse espaço.
Mendeleev estava a usar a sua generalização para prever as propriedades de elementos desconhecidos.
1913
O cientista britânico Henry Moseley descobriu que o número de protões de um elemento era sempre o mesmo, chegando ao conceito de número atómico. Assim, os elementos passaram a estar colocados na Tabela Periódica por ordem crescente do seu número atómico, aproximando-se cada vez mais da Tabela Periódica atual.
1940
Foi descoberto o elemento químico plutónio. Seaborg descobriu todos os elementos de número atómico compreendido entre o 94 e o 102. Efectuou uma nova configuração da Tabela Periódica, tendo recebido o Prémio Nobel da Química, em 1951, pelo seu trabalho.
domingo, 10 de novembro de 2013
Distribuição Eletrónica
É a distribuição dos eletrões por níveis de energia.
Começa-se a distribuição dos eletrões pelo nível de energia (n) mais baixo (n=1) ; depois de totalmente preenchido distribui-se pelo nível seguinte (n=2) e assim sucessivamente.
 |
Nível Camada Nº máximo de eletrões
1º K 2
2º L 8
3º M 18
4º N 32
5º O 32
6º P 18
7º Q 2
eletrões de valência --> são os eletrões do último nível de energia. O átomo tem tendência a receber ou perder eletrões ( 3, no máximo ) , de forma a completar o último nível de energia :
n = 1 --> 2 ; níveis seguintes --> 8 eletrões.
eletrões de valência --> são os eletrões do último nível de energia. O átomo tem tendência a receber ou perder eletrões ( 3, no máximo ) , de forma a completar o último nível de energia :
n = 1 --> 2 ; níveis seguintes --> 8 eletrões.
Iões
Os átomos podem perder ou ganhar eletrões, transformando-se em iões com carga positiva ou negativa :
- nos iões positivos o número de eletrões é menor do que o número de protões.
- nos iões negativos o número de eletrões é maior do que o número de protões.
Representação Simbólica De Um Átomo

Legenda:
X - símbolo do elemento químico
A - nº de massa
Z - nº atómico
Nº de massa (A) : denominamos ao conjunto de todas as partículas do núcleo.
nº de massa = nº protões + nº neutrões (N) A = Z + N
Nº atómico (Z) = nº protões
Isótopos : são átomos do mesmo elemento químico, ou seja, com o mesmo nº atómico (= nº protões) mas diferente nº de massa, já que têm diferente nº de neutrões.
Átomos
Núcleo Atómico (encontra-se no centro do átomo) :
- neutrões --> partículas sem carga elétrica (ou carga nula ou partícula neutra).
- protões --> partículas com carga elétrica positiva.
Nuvem Eletrónica :
- eletrões --> carga elétrica negativa ou seja não tem carga elétrica.
Um átomo é uma partícula neutra, porque --> nº eletrões = nº protões
Evolução do Modelo Atómico
O primeiro modelo atómico foi criado por John Dalton, em 1803, ideia esta retomada da hipótese de Leucipo. Segundo o químico, nas diversas combinações dos átomos, estaria a origem da diversidade das substâncias conhecidas. No modelo concebido por Dalton, os átomos seriam minúsculas esferas maciças, homogéneas, indivisíveis e indestrutíveis.
 |
| modelo de Dalton |
Joseph Thomson, em 1897, provou que os átomos não eram indivisíveis, ao descobrir partículas mais pequenas que o átomo com carga negativa - designadas por eletrões. Isto levou-o a imaginar que os átomos eram corpúsculos de carga positiva onde se encontravam dispersos os eletrões, com carga negativa, em número suficiente para a carga global ser nula.
 |
| modelo de Thomson |
Ernest Rutherford, em 1911, concluiu que o átomo, na sua maioria, era vazio. Isto levou Rutherford a imaginar que os átomos eram constituídos por:
- um núcleo muito pequeno, com carga positiva onde se concentra toda a massa do átomo;
- eletrões com carga negativa movendo-se em volta do núcleo.
 |
| modelo de Rutherford |
Niels Bohr, em 1913, completou o modelo de Rutherford, com as seguintes ideias:
- os eletrões movem-se à volta do núcleo em órbitas circulares;
- a cada órbita corresponde um determinado valor de energia;
- os eletrões com mais energia movem-se em órbitas mais afastadas do núcleo e os que têm menos energia movem-se em órbitas mais próximas do núcleo.
 |
| modelo de Bohr |
Actualmente, está posta de parte a ideia de órbitas circulares para os eletrões.
Os eletrões dos átomos movem-se de modo desconhecido, com velocidade elevadíssima, formando uma espécie de nuvem que não é uniforme: a nuvem eletrónica.
A nuvem eletrónica é mais densa próximo do núcleo, onde é mais provável encontrar os eletrões e menos densa longe do núcleo, onde é menos provável encontrar os eletrões.
| modelo de nuvem eletrónica |
sábado, 8 de junho de 2013
Onda electromagnética e Espectro electromagnético
Onda electromagnética:
- a luz é uma onda electromagnética, logo propaga-se no vazio.
- para uma onda electromagnética periódica podem definir-se: período, frequência, comprimento da onda e amplitude.
Espectro electromagnético:
- é o conjunto das várias radiações electromagnéticas.
Cores da luz
Cores primárias da luz:
- vermelho
- verde
- azul
Cores secundárias da luz:
- vermelho + verde ---> amarelo
- vermelho + azul ---> magenta
- verde + azul ---> ciano
Cores complementares:
- verde + magenta ---> branco
- vermelho + ciano ---> branco
- azul + amarelo ---> branco
- vermelho + verde + azul ---> branco
- amarelo + magenta + ciano ---> branco
 |
Espectro da luz branca
- é o conjunto das radiações de cores ( vermelho, laranja, amarelo, verde, azul, anil e violeta ).
Dispersão da luz
- é um fenómeno que ocorre quando a luz branca se decompõe nas diferentes radiações monocromáticas.
 |
Defeitos da visão
- alguns defeitos de visão podem ser corrigidos com lentes.
- Miopia
- a imagem dos objetos distantes é focada à frente da retina e não sobre ela.
- é consequência de um globo ocular demasiado longo ou um cristalino demasiado convergente.
- corrige-se com lentes divergentes.
- Hipermetropia
- a focagem da imagem dos objetos é feita atrás da retina, devido a uma deficiência no globo ocular ou devido a um cristalino pouco convergente.
- corrige-se com lentes convergentes.
- Presbiopia
- é a « vista cansada » e surge quando o cristalino perde a capacidade de focar os objetos devido à rigidez dos músculos.
Formação das imagens
- a quantidade de luz que pode atravessar a córnea é controlada pela pupila;
- a pupila abre-se quando há menos luz e fecha-se quando há muita luz;
- a luz que atravessa a córnea é focada pelo cristalino, que funciona como lente;
- esta focagem permite projetar as imagens dos objetos numa certa zona da retina;
- a imagem que se obtém é invertida e menor do que o objeto.
Constituição do olho
- Órbita
- é uma cavidade óssea onde se encontra alojado o olho.
- Humor aquoso e Humor vítreo
- são dois tipos de fluidos que se encontram no interior da órbita.
- Esclerótica
- é uma membrana que reveste o globo ocular, de aspecto branco, opaco e duro, que está localizada na parte interna do olho.
- Córnea
- é uma membrana que reveste o globo ocular, de aspecto transparente, que se encontra situada na parede externa do olho.
- Íris
- é uma membrana que se situa na parte mais externa do olho, e a sua cor varia de pessoa para pessoa.
- é constituída por um anel de músculos que controlam a abertura da pupila.
- Pupila
- é uma abertura circular que se localiza atrás da córnea e que se apresenta negra.
- Cristalino
- encontra-se atrás da pupila e permite focar os objetos.
- Retina
- é uma membrana que se localiza na parte interna do globo ocular. É na retina que se formam as imagens.
- Nervo óptico
- a retina encontra-se ligada ao nervo óptico, que, por sua vez, comunica com o cérebro.
 |
Visão
Lentes
- são corpos transparentes limitados por uma ou duas superfícies curvas.
Lentes convergentes / bordos delgados
- um feixe paralelo ao eixo principal converge para um ponto: o foco real.
 |
Lentes divergentes / bordos espessos
- um feixe de raios paralelos ao eixo principal diverge de tal modo que os seus prolongamentos se encontram num ponto: o foco virtual.
 |
Reflexão total
- é um fenómeno que ocorre quando a luz incide, com um ângulo superior ao ângulo crítico, na superfície de separação de dois meios, sendo a velocidade de propagação da luz menor no meio onde a luz está a propagar-se;
- este fenómeno tem aplicação nas fibras ópticas, que podem transportar sinais luminosos a grandes distâncias.
 |
Refração da luz
- é um fenómeno que ocorre quando a luz passa de um meio para o outro, onde a velocidade de propagação é diferente.
- quando a luz é refractada, sofre mudança de direção, excepto se a incidência for perpendicular à superfície de separação dos meios.
- o ângulo crítico ou ângulo limite é o ângulo de refração é de 90º.
 |
Espelhos
- são superfícies polidas onde ocorre a reflexão regular da luz.
- Espelhos planos
imagens obtidas:
- são direitas e do mesmo tamanho que o objeto;
- estão à mesma distância do espelho que o objeto;
- são virtuais;
- são lateralmente invertidas.
Espelhos Esféricos:
- Côncavos
- a superfície polida é a superfície interior de uma esfera.
- os raios incidentes paralelos ao eixo principal quando são refletidos convergem para um ponto, que se designa foco principal do espelho. Este é um foco real, porque pode ser projetado num alvo.
- os raios incidentes paralelos ao eixo principal quando são refletidos convergem para um ponto, que se designa foco principal do espelho. Este é um foco real, porque pode ser projetado num alvo.
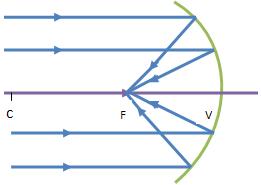 |
- Convexos
- a superfície polida é a superfície exterior de uma esfera.
- os raios incidentes paralelos ao eixo principal quando são refletidos divergem. Os prolongamentos dos raios refletidos encontram-se num ponto, o foco principal do espelho. Este é um foco virtual, porque não pode ser projetado.
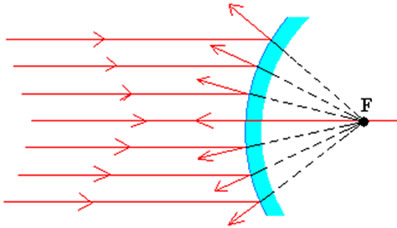 |
Reflexão regular da luz e Difusão da luz
Reflexão regular da luz
- os raios de um feixe luminoso paralelo são todos refletidos na mesma direção;
- este fenómeno ocorre em superfícies polidas.
Difusão da luz
- os raios luminosos de um feixe paralelo são refletidos em diferentes direções;
- este fenómeno ocorre em superfícies rugosas.
Reflexão da luz
- é um fenómeno que ocorre quando a luz incide numa superfície, mudando de direção ou de sentido e continuando a propagar-se no mesmo meio.
Leis da reflexão da luz
- o raio incidente, o raio refletido e a normal estão no mesmo plano;
- os ângulos de incidência e de reflexão são iguais (têm a mesma amplitude).
Triângulo de Visão
- para observar um objeto é necessário que este emita parte (ou a totalidade) da luz que recebeu, de uma fonte luminosa, para um detetor.
- o objeto, a fonte luminosa e o detetor constituem o triângulo de visão.
 |
Corpo luminoso e Corpo iluminado
corpo luminoso - tem luz própria.
corpo iluminado - reflete ou transmite a luz que recebe dos corpos luminosos.
Classificação dos feixes luminosos quanto ao modo de propagação
- Convergentes
o feixe de luz converge (concentra-se) num ponto.
- Divergentes
o feixe de luz diverge a partir de um ponto da fonte.
- Paralelos
o feixe de luz propaga-se sempre com os raios paralelos entre si.
- ao propagar-se a luz pode atravessar:
- Materiais transparentes
a luz atravessa o material e vê-se nitidamente através da vitrina.
- Materiais translúcidos
a luz atravessa parcialmente o material e vê-se com pouca nitidez através da porta.
- e não atravessa:
- Materiais opacos
a luz não atravessa o material e não se vê através da porta.
- a sombra e a penumbra surgem quando a luz, propagando-se rectilineamente, encontra um objeto opaco (obstáculo).
Luz
- a luz propaga-se em linha reta e radialmente em todas as direções, num meio isotrópico.
Sinal luminoso
- é toda e qualquer forma de comunicar usando a luz.
 |
| semáforos |
Surdez
Algumas causas:
- exposição a sons de intensidade muito elevada;
- malformações;
- infeções permanentes.
Nível Sonoro e Audiogramas
nível sonoro - é uma escala (medida em decibéis) que avalia comparativamente as intensidades dos sons.
audiogramas - são gráficos onde se representa o limiar da audibilidade em função da frequência e do nível de intensidade sonora.
Espectro sonoro
- é o conjunto de todas as frequências possíveis para as ondas sonoras.
- Infra-sons
frequência abaixo de 20 Hz
- Sons
frequência entre os 20 e os 20 000 Hz (sons audíveis pelo ouvido humano)
- Ultra-sons
frequência acima de 20 000 Hz
 |
Ouvido humano
- para conseguirmos ouvir um som, é necessário que este seja produzido pela fonte sonora, que a onda se propague num determinado meio e que chegue ao nosso ouvido, onde é percepcionado.
- o ouvido humano encontra-se dividido em três regiões: ouvido externo, ouvido médio e ouvido interno.
 |
Fenómenos do som
Eco - é a repetição do som original.
- para ocorrer eco, a pessoa tem de estar a 17 ou mais metros de distância do obstáculo.
 |
Reverberação - é a prolongação do som original.
- para ocorrer reverberação, a pessoa tem de estar a menos de 17 metros de distância do obstáculo.
- este fenómeno ocorre devido à reflexão das ondas sonoras.
Ressonância - origina um aumento da intensidade do som.
Som no ar ---> 340 m/s
Propagação do som
- o som não se propaga no vazio, pois necessita de um meio material.
A propagação das ondas sonoras é mais rápida:
sólido > líquido > gasoso
Propriedades do som
- Altura do som
A altura do som depende da frequência da onda sonora e permite classificar os sons em: agudos (altos ou finos) e graves (baixos ou grossos).
- Intensidade do som
Está relacionada com a amplitude da onda sonora e permite classificar os sons em: fortes e fracos.
- Timbre
É a propriedade do som que permite distinguir sons com a mesma intensidade e altura, mas provenientes de fontes sonoras diferentes.
sábado, 2 de março de 2013
Características de uma onda periódica
Numa onda periódica, todas as partículas do meio vibram de igual forma.
- no mesmo instante pode haver uma partícula que se encontra na posição de equilíbrio;
- outra partícula que se encontra abaixo da posição de equilíbrio;
- e ainda uma outra partícula que se encontra acima da posição de equilíbrio.
Diz-se que estão na mesma fase de vibração, se duas partículas se encontram na mesma posição relativamente ao equilíbrio. Assim, uma onda periódica pode ser caracterizada por diferentes grandezas.
Elongação - é a diferença de posição entre qualquer ponto e o equilíbrio.
Comprimento de Onda - é a distância mínima entre dois pontos que se encontram na mesma fase.
Numa onda de deslocamento, a amplitude (A) corresponde à distância máxima da elongação e exprime-se em metro (unidade de base do Sl).
Frequência da Onda (f) - corresponde ao número de ciclos (oscilações) que se completam em cada segundo.
Período (T) - é o intervalo de tempo mínimo decorrido até que o fenómeno retome as mesmas características --- tempo necessário para se completar um ciclo.
T = 1/f ou f = 1/T
Ondas Sonoras
O som é produzido pela vibração de uma fonte sonora. Essa vibração transmite-se através de um meio material até aos ouvidos, onde é percepcionada.
As zonas de compreensão (aproximação das partículas) correspondem a cristas e as de rarefacção (afastamento das partículas) a vales.
À vibração de uma fonte sonora está associada energia de movimento (energia cinética), a qual é transferida através da onda enquanto esta se propaga no meio material.
Ondas
Ondas - é uma perturbação que se inicia num ponto e se propaga, transferindo energia de um ponto para o outro.
Ondas Mecânicas - correspondem à propagação de perturbações do meio material.
Ondas Electromagnéticas - não necessitam de um meio material para se propagar, propagam-se no vazio.
Ondas Longitudinais - são aquelas em que a direcção de propagação coincide com a direcção de vibração.
Ondas Transversais - a direcção de propagação e a de vibração são perpendiculares.
O som propaga-se através de ondas longitudinais e a luz por ondas transversais.
Som
Som - é uma onda e para se propagar precisa de um suporte material. Os sons são produzidos por vibrações.
De acordo com a forma como se produzem os sons nos instrumentos musicais, estes dividem-se em três grandes famílias:
sexta-feira, 1 de março de 2013
Formas Fundamentais de Energia
A energia agrupa-se em duas formas fundamentais:
- Energia cinética;
- Energia potencial.
Energia Cinética
A energia cinética (Ec) é a energia associada ao movimento dos corpos. Esta energia depende da massa (m) do corpo e da velocidade (v) a que o corpo se desloca.
Ec = 1/2 x m x v2
v --> velocidade a que o corpo se move
Energia Potencial
A energia potencial (Ep) é a energia que se encontra armazenada nos corpos.
Energia potencial química:
- associada aos alimentos;
- associada aos combustíveis;
- associada às pilhas e baterias.
Energia potencial elástica:
- (materiais elásticos e molas)
Energia potencial gravítica:
Epg = m x g x h
Fontes Renováveis e Não-Renováveis de Energia
As fontes de energia podem classificar-se em:
- Fontes primárias;
- Fontes secundárias.
Fontes Primárias de Energia - são os recursos naturais que podem ser utilizados como fontes de energia.
Exemplo: a água, o vento, a radiação solar...
Fontes Secundárias de Energia - são obtidos a partir das fontes primárias de energia.
Exemplo: eletricidade
As fontes primárias de energia ainda podem ser classificadas em:
- Fontes não-renováveis de energia;
- Fontes renováveis de energia.
Fontes Não-Renováveis de Energia - demoram centenas de milhares de anos a formar-se e esgotam-se à medida que vão sendo utilizadas.
Fontes Renováveis de Energia - estão em contínua renovação, podendo ser utilizadas de forma ilimitada.
Exemplo:
Sol --> energia solar
Vento --> energia eólica
Ondas e Marés --> energia das marés/ondas
Rios --> energia hídrica
Energia
A energia transfere-se entre os corpos, como por exemplo, os alimentos transferem energia para as pessoas.
Manifestações de Energia:
Energia Elétrica --> existência de uma corrente elétrica
Energia Térmica --> aquecimento dos corpos
Energia Sonora --> produção de sons
Energia Mecânica --> movimento
Energia Química --> conteúdo energético das substâncias
Energia Radiante --> diferentes radiações
Enzimas
Enzimas - são proteínas que se encontram naturalmente nos organismos vivos e cuja função é catalisar algumas reações químicas. As enzimas são catalisadores de origem biológica.
Catalisadores
Catalisadores - são substâncias que numa reação química alteram a velocidade da reação, mas não se consomem. Os catalisadores não são reagentes, logo influência a velocidade da reação química, mas no final, a quantidade de catalisador é a mesma do que inicialmente.
Inibidores - são denominados inibidores ou catalisadores de ação negativa, quando o efeito é reduzir (-) a velocidade da reação química.
Catalisadores de Ação Positiva - são denominados catalisadores de ação positiva ou catalisadores, quando o efeito é aumentar (+) a velocidade da reação química.
Subscrever:
Mensagens (Atom)





